« Les maladies rares ont une histoire avec la France. »
- France et maladies rares : une histoire à enrichir
Les maladies rares ont une histoire avec la France. En effet, l’organisation de la filière maladies rares en France est exemplaire et participe à son rayonnement. A l’instar de la politique européenne, il existe ainsi un fort intérêt à tirer parti de l’organisation d’un accès au marché spécifique pour les maladies rares. En Europe, certains pays ont fait le pari réussi du continuum de la recherche à l’accès au marché, et profitent ainsi des investissements des industriels.
L’organisation des filières maladies rares en France est un exemple mondial. Mieux qu’ailleurs, l’accès des patients à un diagnostic et à des essais cliniques y est garanti, les connaissances sur les pathologies sont sans cesse améliorées en enrichissent les parcours de soins et les formations des professionnels. D’autres atouts stratégiques, comme les compétences hospitalo-universitaires ou le Health data hub contribuent à faire de la France un pays ambitieux dans la lutte contre les maladies rares. Ces dernières sont au nombre d’environ 7000, touchent 3 millions de français et sont à 95% orphelines – c’est-à-dire ne présentant pas de traitement disponible[1].
La plateforme « Maladies rares » regroupe des associations (Alliance Maladies Rares, AFM Téléthon, Eurordis, …), des services d’information des populations vulnérables (Maladies Rares Info Services), de connaissance scientifique (Orphanet, portail européen des maladies rares et des médicaments orphelins) et de recherche (Fondation Maladies Rares). Ce formidable ensemble d’acteurs a su faire connaître la problématique spécifique des maladies rares, et a permis de donner naissance au Plan national maladies rares (PNMR). Son objectif est de partager l’innovation, en vue de permettre un diagnostic et un traitement pour chacun.
Le troisième Plan national maladies rares (PNMR3), toujours en vigueur, est impacté directement ou indirectement sur sept de ses onze axes par la mise sur le marché de nouveaux traitements. En effet, ces derniers favorisent, grâce aux différentes actions menées par les fabricants de médicaments, un effet d’entraînement à différents niveaux :
- un intérêt partagé à l’amélioration du diagnostic du fait de la disponibilité d’un traitement
- le dépôt d’une demande de remboursement auprès des autorités de santé pour l’accès au traitement
- la recherche d’une optimisation des parcours de soins autour de la communauté des acteurs de la prise en charge puis de l’ensemble des parties prenantes
- la conduite de la recherche et le soutien financer des équipes, des registres et de la formation
- l’identification des équipes médicales vers qui orienter les patients pour confirmer le diagnostic et initier les traitements, organisées en filières par pathologie et groupe de pathologies
Toutefois, force est de constater que des traitements ayant franchi toutes ces barrières se trouvent aujourd’hui bloqués dans une impasse en raison des barrières d’accès au marché mises en place en France. Ainsi, il manque à l’édifice de la politique nationale de maladie rare une pierre essentielle : celle d’une véritable vision industrielle au profit de l’accès au plus grand nombre à des thérapies innovantes. Partout dans le monde, des dizaines de laboratoires appuyés sur des centaines de chercheurs investissent dans le développement de solutions qui peuvent changer radicalement voire sauver la vie de centaines de milliers de patients. Sans réelle politique française en faveur de l’innovation, le continuum de prise en charge du diagnostic au traitement est rompu dans de nombreux cas, comme les exemples que nous avons développés plus haut le démontrent.
- Une nécessité pour l’avenir : sortir du déclassement
Les nouvelles innovations thérapeutiques, qu’il s’agisse de médicaments ou de dispositifs médicaux, marqueront durablement le XXIe siècle et apporteront des progrès médicaux jamais atteints. Ces progrès médicaux correspondent non seulement à une promesse d’amélioration durable de la qualité de vie, voire de guérison, pour les malades, mais également à une transformation attendue du système de santé.
En effet, alors que le vieillissement de la population et le cumul, avec l’âge, des pathologies semble condamner à la prise de traitements chroniques coûteux pour le système de santé comme pour la qualité de vie des malades, les révolutions thérapeutiques qui s’expriment parfois en termes de guérison représentent un immense espoir. Ces innovations repensent le lien entre les malades et la médecine, car les thérapies du XXIe siècle sont adaptées à chaque malade, visent quelques populations-cibles et sont personnalisées en fonction des évolutions de la maladie propres à chaque personne. Les exemples des thérapies ciblées dans le cancer ou encore des CAR T-Cells sont ainsi éloquents. Cette individualisation des thérapies peut, si la France s’engage dans une politique réellement décloisonnée et efficace en matière de soutien à l’innovation, signer l’avènement de la médecine des « 4P » :
- participative, car mettant en avant l’ère du « patient-expert » et d’une réelle implication du malade dans son parcours de santé
- personnalisée, car adaptée à chaque malade et à son profil médical et social
- préventive, car s’intéressant aux déterminants populationnels des maladies rares et au dépistage précoce
- prédictive, car développant des solutions permettant de soigner voire de guérir d’une maladie grâce à une amélioration des connaissances scientifiques et à une vraie synergie avec l’utilisation des données de santé
L’investissement de la France dans la recherche fondamentale, dans les solutions de transferts de technologies, dans le health data hub et dans la transformation du système de santé vers plus d’implication des soignants et d’adaptation des parcours au bénéfice des malades sont autant d’atouts pour réussir ce défi de l’innovation face aux maladies rares. Le soutien de l’Union Européenne est, dans ce domaine, plus que précieux au niveau industriel, les règlementations de 1999[2] ayant permis une forte accélération de l’innovation thérapeutique.
Il manque, néanmoins, la transformation industrielle à l’échelon nationale – en effet, les pays-membres restent maîtres de ce qui permet de signer, ou non, la pérennisation d’une thérapie ou d’une entreprise sur le territoire national : la définition du panier de soins et la fixation du prix. Comme nous l’avons vu, la France ne se donne pas les moyens de terminer son édifice de lutte contre les maladies rares. Cet abandon de l’attractivité industrielle empêche un effet d’entraînement à plusieurs niveaux :
- Les malades n’ont pas accès, en France, à des thérapies de rupture qui pourraient leur apporter une amélioration significative de leur qualité de vie voire une guérison
- Le continuum de la recherche n’est pas assuré et les entreprises innovantes n’investissent que peu en recherche et développement en France, alors même que l’industrie pharmaceutique fait partie des secteurs qui investissent le plus en la matière[3] et que ces jeunes entreprises sont l’avenir de cette industrie
- Les pays plus attractifs en matière d’innovation pharmaceutique « aspirent » les talents français formés dans notre excellent système d’enseignement supérieur[4]
- Couplé à l’absence de vision pluriannuelle des dépenses d’assurance-maladie, cet abandon empêche les gains médico-économiques et sociétaux lié à la « déchronicisation » de certaines maladies
- L’absence de pérennisation de biotechs françaises ou d’installations de filiales empêche la création d’emplois, de valeurs ou encore le versement de prélèvements obligatoires
- La réputation délétère de la France en matière de soutien à l’innovation s’exporte et a des effets de long terme sur l’attractivité du pays et poussent des entreprises à renoncer à s’installer dans l’hexagone sans même y avoir enclenché des démarches
- Des exemples européens qui marchent
D’autres pays ont opté pour des dispositifs plus ouverts, afin de répondre à cette problématique qui empêche les patients d’avoir accès à un traitement qui constitue bien souvent la seule solution thérapeutique disponible.
L’Italie a une forte volonté de permettre à sa population l’accès à des solutions thérapeutiques innovantes. Dans cette optique, ce pays a créé le Fond des médicaments innovants accompagné d’avantages réglementaires et financiers pour les entreprises. Ce fond représente une enveloppe de 1 Md€ comportant deux volets de 500 M€ pour les médicaments innovants et de 500 M€ pour les médicaments oncologiques innovants. L’accès à ces avantages est obtenu à la suite d’une évaluation de la reconnaissance de l’innovation par le nouvel algorithme de l’AIFA[5] (Agenzia Italiana del Farmaco : Agence italienne du Médicament). Cet algorithme repose sur trois éléments fondamentaux : le besoin thérapeutique, la valeur thérapeutique ajoutée et la robustesse des études cliniques.
Pour les médicaments indiqués dans les maladies rares, l’évaluation de la qualité de preuve tient compte de la difficulté objective de mener des études cliniques de référence et de la puissance adéquate. La solution thérapeutique, en sortie d’algorithme[6], peut obtenir le statut d’innovant, d’innovation potentielle ou de non-innovant. L’obtention du statut d’innovant permet durant une période de 36 mois au chef de file d’une classe thérapeutique d’être financé par le fond des médicaments innovants, d’être exempté du mécanisme de clause de sauvegarde et d’être inclus sur l’ensemble des régions pour un référencement prioritaire. Le statut d’innovation potentielle ne dure que 18 mois.
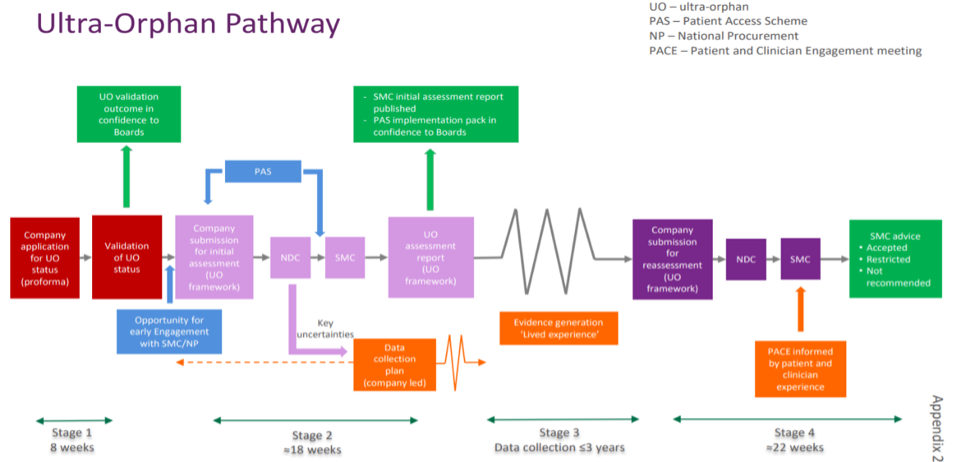
L’Ecosse, également, est une nation favorisant l’accès aux solutions thérapeutiques. À la suite du bilan « Review of Access to New Medicines »[7], une nouvelle voie d’accès aux médicaments ultra-orphelins, plus rapide et adaptée, a été mise en place dès octobre 2018[8]. Elle permet la mise à disposition de solutions thérapeutiques répondant à un besoin médical non couvert dans le domaine des maladies rares et ultra-rares pour une durée de trois ans avant une réévaluation comprenant la présence de données en vie réelle pour une prise en charge de droit commun par le National Health Service (NHS) écossais, équivalent de l’Assurance maladie. Durant cette période de trois ans, la solution est prise en charge par le NHS de façon dérogatoire. Des critères conditionnent le passage par cette voie d’accès dédiée aux maladies ultra-rares, la société pharmaceutique doit :
- valider le statut de traitement ultra-rare selon le Scottish Medicines Consortium (SMC), équivalent de la Haute Autorité de Santé en France
- déposer une demande d’évaluation complète (clinique et médico-économique) de la solution thérapeutique par le SMC
- fournir un Patient Access Scheme (PAS) validé par le Patient Access Scheme Assessment group (PASAG)
- assurer et soutenir la collecte des données de vie réelle en répondant aux exigences de robustesse de preuves permettant la seconde évaluation (évaluation définitive)
La procédure[9] permettant l’accès à ce nouveau mécanisme d’évaluation des solutions thérapeutiques rares et ultra-rares ainsi que les délais d’évaluations sont présentés ci-dessous :
[1] PhRMA, A decade of innovation in rare diseases, 2015, prec. cit.
[2] Règlement (CE) n° 141/2000 du Parlement européen eu du Conseil sur les médicaments orphelins.
[3] Médicaments innovants : prévenir pour mieux guérir, Institut Montaigne, Rapport, Septembre 2019.
[4] ‘Humiliation’ : French see Covid-19 vaccine flops as sign of decline, France 24, 26 janvier 2021.
[5] Classification de l’innovation en Italie : https://www.aifa.gov.it/-/aifa-criteri-per-la-classificazione-dei-farmaci-innovativi-e-dei-farmaci-oncologici-innovativi
[6] Algorithme évaluant l’innovation en Italie : http://cbpartners.com/blog/new-aifa-algorithm-assessing-innovativeness-new-products-italy.html
[7] Bilan « Review of Access to New Medicines » https://www.gov.scot/publications/review-access-new-medicines/pages/1/ Dr Montgomery, décembre 2016
[8] Mise en place d’une nouvelle voie d’accès pour les traitements des maladies et conditions rares et ultra-rares : https://news.gov.scot/news/treatments-for-rare-conditions
[9] Guidance to Submitting Companies for Completion of New Product Assessment Form (NPAF), Supplement for medicines for extremely rare conditions (ultra-orphan medicines),